抗原诱导的细胞表面受体聚集,包括T细胞受体和Fc受体代表了细胞信号激活中的一种广泛机制。然而,由于密度不足,大多数天然存在的抗原,如肿瘤相关抗原,会刺激有限的受体聚集和靶向反应。
2025年9月10日,实验室高强教授联合中国科学院上海生物化学与细胞生物学研究所韩硕教授团队共同在Nature在线发表题为“Amplifying antigen-induced cellular responses with proximity labelling”的研究论文,该研究重新利用邻近标记,一种用于生物素化和鉴定空间近端蛋白质的方法,将设计的探针扩增为细胞表面上的合成抗原簇。
该研究开发了一种由红光或超声波控制的体内邻近标记技术,以在靶抗原附近高密度地共价标记荧光素探针。以T细胞受体为例,证明了扩增的荧光素有效地聚集并引导荧光素结合双特异性T细胞接合器,从而诱导增强的T细胞活化和细胞毒性。在多个同系小鼠肿瘤模型中的非侵入性、组织选择性标记产生有效的免疫反应,快速根除治疗的肿瘤。有效的细胞裂解进一步促进表位扩散,以诱导针对未治疗的远端损伤的系统免疫和针对再次攻击的免疫记忆。因此,邻近标记化学有希望作为一种通用策略来操纵抗抗原依赖性受体功能和细胞状态。
由抗原或配体结合介导的受体聚集是激活多种细胞表面受体的一般机制,包括T细胞受体(TCR),B细胞受体和Fc受体等。抗原可以直接与受体结合,如TCR和嵌合抗原受体(CAR),也可以通过抗体间接结合。这一过程推动了特殊微区的形成,如免疫突触,以刺激和放大下游信号。然而,对于利用这些受体的治疗方法,选择合适的靶抗原是实现有效反应的重要障碍。例如,通常靶向肿瘤相关抗原,如人表皮生长因子受体2(HER2)通常在细胞表面以异质水平表达,并且在健康组织中非特异性存在。由于受体聚集和激活不足,抗原密度不足无法诱导有效的靶向反应,这是治疗性抗体和工程细胞毒性淋巴细胞共同面临的挑战。
为了解决由于抗原稀少而导致的受体激活不足的问题,以前的努力集中在设计优化的CARs或识别低抗原细胞的抗体上。然而,这种策略需要复杂的蛋白质工程来适应个体的构建,并可能加剧靶向的、非肿瘤的毒性。或者,直接操纵细胞表面抗原的方法可广泛用于激活不同类型的膜受体。最近的进展包括抑制细胞内吞作用以增加表面抗原的有效性和肿瘤内给予插入细胞膜的两亲配体。还开发了用溶瘤病毒转导来诱导外源抗原表达。然而,这些方法仅提供了抗原水平的适度增加或缺乏细胞类型特异性或两者兼有。
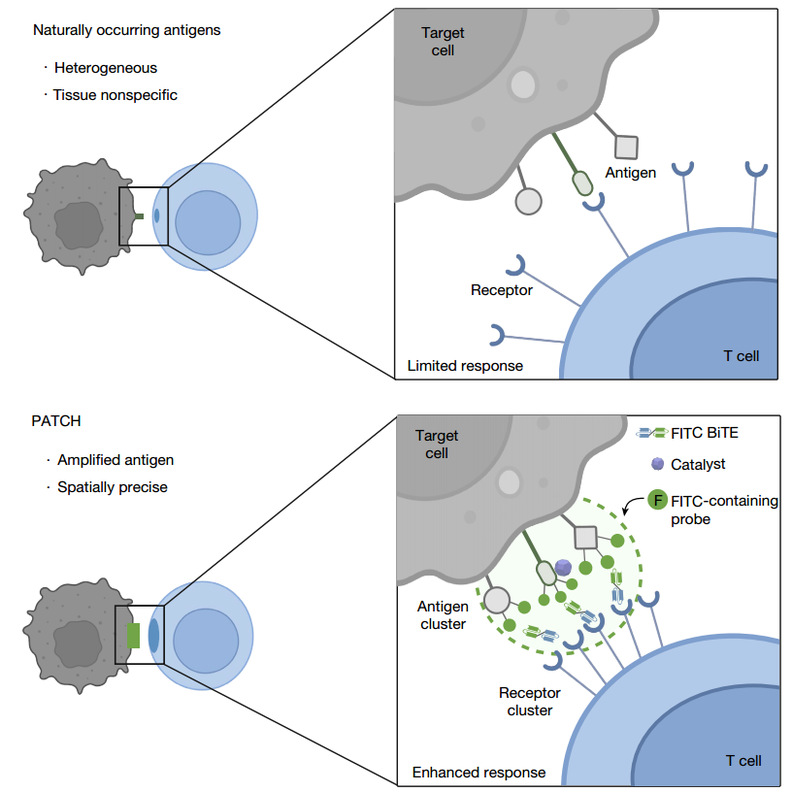
基于靶细胞表面邻近标记的抗原扩增诱导受体聚集和增强效应细胞活化示意图
邻近标记,这是一种化学生物学策略,为蛋白质相互作用的发现提供了动力。这种方法使用酶催化的、混杂反应的中间体对相邻蛋白质进行纳米级生物素化。研究人员推断,通过对设计的半抗原探针进行体内细胞表面标记作为合成抗原,邻近标记反应可以重新用于抗原工程。这种方法将提供高密度共价抗原扩增的优点,以诱导受体聚集和具有精确空间控制的组织特异性标记。
在这项研究中,研究人员提出了一种基于邻近标记化学的策略,以增强聚集诱导的受体激活,并使用TCR作为模型受体来放大下游信号传导。通过开发一种由红光(>680nm)或超声波控制的邻近标记方法,可以通过邻近扩增和标记细胞毒性半抗原(PATCH)在体内将合成抗原引入靶细胞表面。高密度的机械共价锚定PATCH引导PATCH结合双特异性T细胞接合剂(BiTE)刺激TCR聚集和T细胞毒性。体内高效的靶细胞裂解进一步诱导了对未经治疗的远端病变的脓肿反应和对再攻击的免疫记忆。这些发现证明了使用邻近标记化学来促进抗原扩增和重新编程受体簇以增强免疫细胞功能的概念。这不仅为邻近标记技术开辟了新赛道,也为抗原依赖的免疫治疗提供了新思路。
参考信息:
https://www.nature.com/articles/s41586-025-09518-6#Sec47